Параметры процесса горения определяются его материальным и энергетическим балансом.
Основные понятия материального баланса процесса горения.
Материальный баланс процесса горения — соотношение (равенство) между количеством веществ, которые вступают в реакцию горения, и количеством веществ (продуктов горения), которые получаются вследствие этой реакции.
Расход воздуха на горение
При горении происходит взаимодействие между молекулами горючего вещества и окислителя, при этом получаются продукты сгорания.
Горючее вещество + Окислитель ⇒ Продукты сгорания
Как правило, окислителем при горении выступает кислород воздуха. Схематично химическую реакцию сгорания одного моля вещества в воздухе можно представить уравнением:
ГВ + β(О2 + 3,76 N2) = ∑ ni·ПГi + β·3,76N2,
в котором символами ГВ, О2, N2, ПГi обозначены молекулы, соответственно горючего вещества, кислорода, азота и i-го продукта горения; ni — количество молекул i–го продукта горения, приходящееся на одну молекулу горючего; β — стехиометрический коэффициент реакции горения.
Это лишь суммарная реакция, но она достаточна для проведения практических расчетов и является обобщенной записью материального баланса реакции горения.
Минимальный объем воздуха, который необходим для полного сгорания единицы количества горючего вещества, называется удельным теоретическим объемом воздуха и обозначается voв.В зависимости от единиц измерения количества горючего вещества (1 моль, 1 м³, 1 кг) удельный объем измеряется в м³/моль, м³/м³, м³/кг.
Действительное количество воздуха, который поступает в зону горения, отличается от теоретического. Соответствующий объем называется удельным действительным объемом воздуха и обозначается vв.. Разность между количеством воздуха, который идет на горение и теоретически необходимым, называется избытком воздуха. Для характеристики процесса горения используют понятие коэффициент избытка воздуха — αв., который показывает, во сколько раз количество воздуха, который действительно поступает в зону горения, отличается от теоретически необходимого количества для полного сгорания единицы количества горючего вещества.
Таким образом, действительный удельный объем воздуха равняется:
vв = vов · αв.
Часть воздуха, неизрасходованная на горение, переходит в продукты горения.
В случае кинетического горения при αв = 1, смесь горючего с воздухом является стехиометрической. Величина тепловыделения на единицу продуктов сгорания при этом максимальна вследствие чего температура в зоне горения также максимальна.
При αв < 1 — в смеси недостаток окислителя и излишек горючего вещества. Такая смесь называется богатой. Характерной особенностью процесса горения в этом случае является образование продуктов неполного сгорания.
При αв > 1 — смесь называется бедной. В ней недостаток горючего вещества и излишек окислителя. При этом продукты горения включают в себя избыток воздуха.
Продукты горения — это газообразные, твердые и жидкие вещества, образующиеся в процессе горения.
Состав продуктов горения зависит от состава горючего вещества и условий протекания реакции горения. Продукты горения образуют дым.
Дым — дисперсная система, состоящая из твердых и жидких частиц (дисперсной фазы), находящихся в газовой дисперсионной среде.
Свойства дыма характеризуются следующими параметрами:
Концентрация дыма — это масса продуктов горения, находящихся в единице объема. В зоне задымления концентрация продуктов горения находится в интервале от 1·10–4 до 5·10–3 кг/м³.
Наличие конденсированной фазы обуславливает непрозрачность дыма. Степень снижения прозрачности зависит от концентрации, размера и природы частиц дисперсной фазы. Параметром, характеризующим оптические свойства дыма, является плотность задымления.
Плотность задымления — отношение интенсивности света Iп, прошедшего через слой дыма, к интенсивности падающего света Ij.
Dд = Iп/Iо
Содержание кислорода. В обычных условиях содержание кислорода в воздухе составляет 21% (объемный). Снижение концентрации кислорода в воздухе приводит к кислородному голоданию людей. Так при снижении концентрации ниже 16% работа без индивидуальных средств защиты органов дыхания невозможна.
Токсичность продуктов горения — способность продуктов горения вызвать отравления людей, находящихся без индивидуальных средств защиты органов дыхания.
Температура дыма.Температура продуктов горения непосредственно возле зоны горения может достигать 1000°С, но в помещениях температура дыма обычно существенно ниже. Основным фактором, влияющим на температуру дыма, являются условия газообмена. При увеличении коэффициента избытка воздуха температура продуктов горения снижается. Однако опасной для людей температурой считается уже температура 70°С. Продолжительное пребывание при такой температуре связано с риском для жизни из-за перегрева организма.
Стойкость дыма определяют такие параметры дымовых частиц, как:
- маленькая масса;
- высокая удельная поверхность;
- броуновское движение, в котором они находятся;
- наличие на их поверхности электрического заряда.
Продукты неполного сгорания, образующиеся при горении веществ и материалов в закрытых помещениях, при поступлении свежего воздуха могут образовывать горючую смесь. Горение при этом происходит в кинетическом режиме (взрыв).
ОСНОВНЫЕ ПОНЯТИЯ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА ПРОЦЕССА ГОРЕНИЯ
Под тепловым эффектом реакции понимают количество теплоты, которое выделяется или поглощается системой в ходе реакции.
В тех случаях, когда теплосодержание системы после реакции уменьшается (реакция идет с выделением энергии), реакция является экзотермической. Если теплосодержание конечных продуктов выше исходных (реакция идет с поглощением энергии), реакция является эндотермической.
Теплосодержание системы определяется теплотами образования компонентов системы (продуктов горения и исходного вещества). Таким образом тепловой эффект реакции можно записать:
ΔHг = ∑ ΔHofпг − ∑ ΔHofгв,
где ΔHofпг и ΔHofгв — теплота образования продуктов горения и исходных горючих веществ соответственно.
Теплота образования веществ определяется по справочникам или рассчитывается исходя из структуры вещества.
Теплотой сгорания называется количество тепла, выделяющееся при полном сгорании единицы количества вещества при условии, что начальные и конечные продукты находятся в стандартных условиях.
Различают молярную Q — для одного моля (кДж/моль), массовую Q′ − для одного килограмма (кДж/кг), объемную Q″ − для одного кубического метра вещества (кДж/м³) теплоту сгорания.
В зависимости от агрегатного состояния воды, образовавшейся в процессе горения, различают высшую Qв и низшую Qн теплоту сгорания.
Высшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества (жидком) состоянии.
Низшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества при условии, что вода в продуктах горения находится в газообразном состоянии.
Молярную теплоту сгорания рассчитывают в соответствии с законом Гесса:
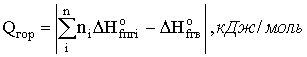
Для переcчета молярной теплоты сгорания Q в массовую Q′ можно использовать формулу:
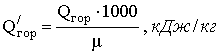 ,
,
где μ — молярная масса горючего вещества , кг/кмоль.
Для веществ в газообразном состоянии при пересчете из стандартной теплоты сгорания Q в объемную Q″ используют формулу:
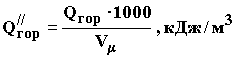 ,
,
где Vμ — объем киломоля газа, который при стандартных условиях составляет 22,4 м³/кмоль.
Для сложных горючих веществ или смесей можно вывести формулу определения теплоты сгорания исходя из состава и процентного содержания компонентов.
Достаточно точные результаты дает формула Менделеева для высшей теплоты сгорания:
Qв′ = 339,4·φС + 1256,8·φН + 108,9(φS − φO – φN), кДж/кг,
где φO, φN, φS, φС, φН — процентное содержание кислорода, азота, серы, углерода, водорода в горючем веществе.
Для низшей теплоты сгорания:
Qн′ = Qв′ – 25,1(9·φН + W%), кДж/кг,
где W% − содержимое влаги в горючем веществе.
Теплота сгорания имеет большое практическое значение при расчете пожарной нагрузки и параметров пожара.
Под пожарной нагрузкой Рпож понимают количество тепла, которое может выделиться при сгорании веществ и материалов, приходящихся на один квадратный метр поверхности пола помещения, МДж/м².
Пожарная нагрузка является количественной характеристикой, определяющей тепловое влияние пожара на строительные конструкции. Пожарную нагрузку рассчитывают как сумму произведений масс всех горючих материалов на их низшую теплоту сгорания, отнесенную к единице поверхности пола по формуле:
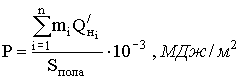
Низшая теплота сгорания также используется для определения пожарной опасности горючих веществ. Экспериментально доказано, что вещества являются негорючими, если они не относятся к взрывоопасным и их низшая теплота сгорания меньше, чем 2100 кДж/кг или 1830 кДж/м³.
ТЕМПЕРАТУРА ГОРЕНИЯ
Тепло, выделяющееся в зоне горения, расходуется на нагревание продуктов горения и теплопотери (к последним относятся предварительный нагрев горючего вещества и излучение из зоны горения в окружающую среду).
Максимальная температура в зоне горения, до которой нагреваются продукты горения, называется температурой горения.
В зависимости от условий, в которых протекает процесс горения различают калориметрическую, теоретическую, адиабатическую и действительную температуры горения.
Под калориметрической температурой горения понимают температуру, до которой нагреваются продукты горения при соблюдении следующих условий:
1) все тепло, выделившееся в процессе реакции, идет на нагревание продуктов горения;
2) происходит полное сгорание стехиометрической горючей смеси, коэффициент избытка воздуха αв = 1;
3) в процессе образования продуктов горения не происходит их диссоциация;
4) горючая смесь находится при начальной температуре 273К и давлении 101,3 кПа.
Теоретическая температура горения отличается от калориметрической тем, что в расчетах учитываются теплопотери на диссоциацию продуктов горения.
Диссоциацию продуктов горения нужно учитывать при температурах выше 1700°С.
Адиабатическая температура горения отличается от калориметрической тем, что определяется с учетом коэффициента избытка воздуха.
Действительная температура горения — это температура, до которой нагреваются продукты горения в реальных условиях.
Температуру горения используют при расчетах давления взрыва, для определения площади легкосбрасываемых конструкций, температуры пожара и других параметров.